Μελέτη για τα χημικά συστατικά
και τις φαρμακολογικές δράσεις του Κόρντισεπς Σίνενσις
Περίληψη
Το Κόρντισεπς Σίνενσις, (κινέζικη ονομασία: DongChongXiaCao) γίνεται ολοένα και πιο δημοφιλές και σημαντικό για τις δημόσιες και επιστημονικές κοινότητες. Αυτή η μελέτη συνοψίζει τα χημικά συστατικά και τις αντίστοιχες φαρμακολογικές δράσεις του Κόρντισεπς Σίνενσις.
Advertisment
Πολλά βιοδραστικά συστατικά του Κόρντισεπς Σίνενσις έχουν εξαχθεί συμπεριλαμβανομένων: νουκλεοσίδια, πολυσακχαρίτες, στερόλες, πρωτεΐνες, αμινοξέα και πολυπεπτίδια. Επιπρόσθετα, οι αντίστοιχες φαρμακολογικές δράσεις που έδειξε η μελέτη είναι: αντιφλεγμονώδεις, αντιοξειδωτικές, αντικαρκινικές, αντιαποπτωτικές και ανοσορρυθμιστικές.
Ως εκ τούτου, οι διαφορετικές επιδράσεις του Κόρντισεπς Σίνενσις μπορούν να χρησιμοποιηθούν ενάντια σε διάφορες διαταραχές και να χρησιμοποιηθούν ως αναφορά για την μελλοντική μελέτη του Κόρντισεπς Σίνενσις.
Cordyceps: Το αντιγηραντικό φαρμακευτικό μανιτάρι που προάγει την σωματική εκγύμναση
Advertisment
1. Εισαγωγή
Το γένος Κόρντισεπς είναι ένα σημαντικό είδος των φαρμακευτικών μανιταριών [1-5]. Το Κόρντισεπς είναι συγκεκριμένοι μακρομύκητες λόγω της χαρακτηριστικής παρασιτικής του δράσης σε προνύμφες και νύμφες εντόμων. Ως πλειομορφικός μύκητας που διανέμεται σε όλο τον κόσμο, το Κόρντισεπς είναι ιδιαίτερα άφθονο σε τροπικά δάση και υγρές εύκρατες περιοχές [3-5]. Εντός του γένους Κόρντισεπς, μέχρι σήμερα έχουν περιγραφεί πάνω από 400 είδη [4, 5], εκ των οποίων το Κόρντισεπς Σίνενσις αναγνωρίζεται ως το πιο ισχυρό.
Το Κόρντισεπς Σίνενσις έχει διάφορες βιολογικές δράσεις και έχει χρησιμοποιηθεί εκτενώς ως τονωτικό και ως συμπλήρωμα υγείας σε ασθενείς, ιδίως στους ηλικιωμένους, στην Κίνα και σε άλλες ασιατικές χώρες.
Μέχρι τώρα, πολυάριθμα βιοδραστικά συστατικά εξαχθεί όπως Κορντισεπίνη, πολυσακχαρίτες, εργοστερόλη, μαννιτόλη και αδενοσίνη [6, 7].
Εν τω μεταξύ, διάφορες φαρμακολογικές δράσεις αυτών των χημικών συστατικών έχουν αναφερθεί, συμπεριλαμβανομένων των:
– δράσης κατά του όγκου,
– ηπατοπροστατευτική δράση
– αντιφλεγμονώδη δράση, και
– αντιοξειδωτικές ιδιότητες,
– νεφροπροστατευτικές ιδιότητες, και
– αντιαποπτωτικές ιδιότητες [8-14].
Για να συνοψίσουμε, η επίδραση του Κόρντισεπς Σίνενσις ίσως προκαλείται από ένα μόνο δραστικό συστατικό ή από την συνδυασμένη δράση πολλών δραστικών παραγόντων που διαθέτει.
Η έρευνα είναι απαραίτητη για να υπάρξει μια γενική εικόνα για το Κόρντισεπς Σίνενσις λόγω του αυξανόμενου ενδιαφέροντος από την ιατρική και την μυκητολογία [15, 16]. Ως εκ τούτου, η μελέτη μας εξέτασε τα χημικά συστατικά και τις αντίστοιχες φαρμακολογικές δράσεις του Κόρντισεπς Σίνενσις για τον σημαντικό ρόλο του στην ανάπτυξη νέων φαρμάκων και ιαματικών προσεγγίσεων σε διάφορες διαταραχές.
Επιπλέον, συνειδητοποιώντας την φαρμακολογική δράση της μονομερούς σύνθεσης θα μπορούσε να ενισχύσει την αποτελεσματικότητα των φαρμάκων μέσω της εξαγωγής ενός μόνο συστατικού του Κόρντισεπς Σίνενσις. Ως εκ τούτου, είναι αναγκαίο να επανεξεταστεί η ανάπτυξη στην έρευνα του Κόρντισεπς Σίνενσις
2. Χημικά Συστατικά και Αντίστοιχές Φαρμακολογικές Δράσεις του Κόρντισεπς Σίνενσις
2.1. Νουκλεοσίδια
Τα νουκλεοσίδια, ένα σημαντικό δραστικό συστατικό του Κόρντισεπς Σίνενσις, χρησιμοποιούνται ως ένας πολύτιμος χημικός δείκτης για τον ποιοτικό έλεγχο του Κόρντισεπς [1]. Εκτός αυτού, τα νουκλεοσίδια παίζουν σημαντικό ρόλο στην ανάπτυξη φαρμάκων για τον καρκίνου και για λοιμώδη νοσήματα, και τα νουκλεοσίδια και τα παράγωγα τους έχουν χρησιμοποιηθεί ευρέως σε αντικαρκινικές και αντιικές θεραπείες.
Διαδοχικά, πάνω από 10 νουκλεοσίδια και οι σχετικές ενώσεις τους, συμπεριλαμβανομένων των αδενίνη, αδενοσίνη, ινοσίνη, κυτιδίνη, κυτοσίνη, γουανίνη, ουριδίνη, θυμιδίνη, ουρακίλη, υποξανθίνη, και γουανοσίνη, έχουν απομονωθεί από το Κόρντισεπς Σίνενσις. Σχεδόν όλα τα νουκλεοτίδια και τα νουκλεοσίδια του Κόρντισεπς Σίνενσις μπορούν να μετασχηματιστούν αμοιβαίως [17]. Επιπλέον, πολλοί επιστήμονες άρχισαν να μελετούν τις φαρμακολογικές επιδράσεις του και είχαν πολλά επιτεύγματα [18, 19].
Μια σειρά από έρευνες για τα νουκλεοσίδια διεξήχθησαν. Για παράδειγμα, τα νουκλεοσίδια μπορούν να ρυθμίσουν και να ελέγξουν τις φυσιολογικές δραστηριότητες του ανθρώπινου σώματος μέσω πουρινεργικών ή / και πυριμιδινικών υποδοχέων [17]. Ως εκ τούτου, ο προσδιορισμός των νουκλεοτιδίων και των σχετικών ενώσεων τους είναι εξαιρετικά σημαντικός για τη φαρμακολογική μελέτη και τον έλεγχο ποιότητας του Κόρντισεπς Σίνενσις και των προϊόντων του.
 2.1.1. Κορντισεπίνη
2.1.1. Κορντισεπίνη
Η Κορντισεπίνη είναι μια κατηγορία ενώσεων που επιδεικνύει σημαντικό ιαματικό δυναμικό και έχει πολλούς ενδοκυτταρικούς στόχους, συμπεριλαμβανομένων των νουκλεϊκών οξέων, της απόπτωσης και του κυτταρικού κύκλου. Οι Tuli et al. ερεύνησαν την ποικιλία των μοριακών μηχανισμών που μεσολαβούν για τις φαρμακολογικές επιδράσεις της Κορντισεπίνης. Εκτός αυτού, κρίνουν ότι η Κορτνισεπίνη μπορεί να συμμετέχει σε διάφορες μοριακές διαδικασίες στα κύτταρα λόγω της ομοιότητάς του με την αδενοσίνη [7].
Οι Wang et al ερεύνησαν τις επιδράσεις της Κορντισεπίνης στην πρόληψη του τραυματισμού της εστιακής εγκεφαλικής ισχαιμικής / επαναδιάχυσης (IR) και πρότεινε ότι η Κορντισεπίνη έχει νευροπροστατευτική δράση στον ισχαιμικό εγκέφαλο, η οποία οφείλεται στην αναστολή της φλεγμονής και στην αύξηση της αντιοξειδωτικής δραστηριότητας που σχετίζεται με την βλάβη της παθογένεσης [23, 24]. Έτσι, η Κορντισεπίνη θα μπορούσε να είναι ένας ελκυστικός ιαματικός υποψήφιος με από του στόματος δραστικότητα έναντι σε I / R σχετιζόμενες καρδιακές παθήσεις όπως το έμφραγμα του μυοκαρδίου [25].
Οι Qian et al θεωρούν ότι η Κορντισεπίνη είναι μία ισχυρή αντι-φλεγμονώδη και αναλγητική ουσία [27, 28]. Επιπρόσθετα, η Κορντισεπίνη διέγειρε την απελευθέρωση ορισμένων κυτοκινών και επηρέασε τον πολλαπλασιασμό των PBMC και των παραγόντων μεταγραφής σε ΤΗΡ-1 κυτταρική γραμμή. Με ανάλογο τρόπο, η Κορντισεπίνη μπορεί να ρυθμίζει εντατικά τις λειτουργίες των ανθρώπινων ανοσοποιητικών κυττάρων in vitro [30]. Εκτός αυτού, η Κορντισεπίνη διαθέτει όχι μόνο αντικαρκινική δράση, αλλά επίσης αντιβακτηριακή και αντιιική δράση [2].
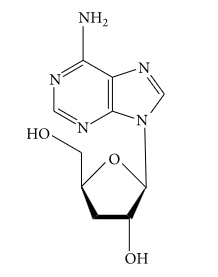
 2.1.2. Αδενοσίνη
2.1.2. Αδενοσίνη
Η αδενοσίνη (Εικόνα 2) παίζει σημαντικό ρόλο στη βιοχημική διεργασία στον οργανισμό [31]. Το περιεχόμενο της αδενοσίνης είναι πολύ υψηλότερο στο καλλιεργημένο Κόρντισεπς Σίνενσις από ότι είναι στο φυσικό[32-34]. Η αδενοσίνη μπορεί να ασκήσει ένα ευρύ φάσμα κυτταροπροστασίας ή πρόληψης βλαβών στους ιστούς, όπως στην αντιμετώπιση της χρόνιας καρδιακής ανεπάρκειας, αντιφλεγμονώδεις ιδιότητες και αντισπασμωδική δράση [35-38].
Επιπρόσθετα, η αδενοσίνη έχει αναφερθεί ότι καταστέλλει την κυτταρική ανάπτυξη μέσω ποικίλων εξωγενών και ενδογενών μονοπατιών σηματοδότησης. Και στις δύο οδούς, αδενοσίνη ενεργοποιεί κασπάσες σε μιτοχόνδρια που εξαρτώνται ή / και ανεξάρτητη από τον τρόπο [39-41]. Η αδενοσίνη διαδραματίζει σημαντικό ρόλο στο ανοσοποιητικό και στην φλεγμονή, και διαδραματίζει σημαντικό ρόλο στην κατάθλιψη και στο άγχος [45].
Ειδικότερα στα κύτταρα του δέρματος, αυτό το ενδογενές νουκλεοσίδιο, θα μπορούσε να συμμετάσχει στην προστασία και στην ανάπλαση των ιστών του δέρματος. Συνοψίζοντας, η αδενοσίνη και τα ανάλογα της έχουν λάβει τόσο μεγάλη προσοχή λόγω των ποικίλων φαρμακολογικών επιδράσεων τους.
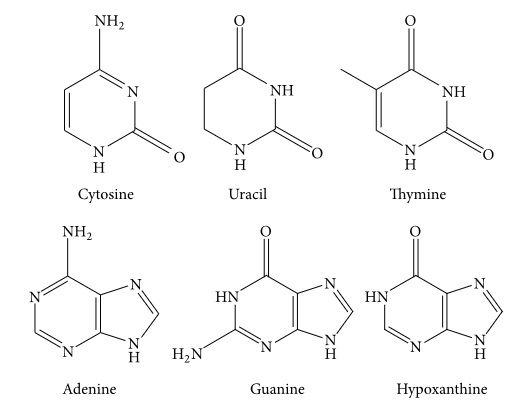
 2.1.3. Νουκλεοβάσεις
2.1.3. Νουκλεοβάσεις
Μέχρι σήμερα, έξι νουκλεοβάσεις (Εικόνα 3), συμπεριλαμβανομένων των κυτοσίνη, ουρακίλη, θυμίνη, αδενίνη, γουανίνη και υποξανθίνη, προσδιορίστηκαν στα φυσικά και στα καλλιεργημένα Κόρντισεπς Σίνενσις. Το συνολικό περιεχόμενο των νουκλεοσιδίων είναι πολύ υψηλότερο στα καλλιεργημένα Κόρντισεπς Σίνενσις σε σχέση με τα φυσικά [32]. Οι φαρμακολογικές επιδράσεις για τις νουκλεοβάσεις δεν έχουν αναφερθεί μέχρι σήμερα.
2.1.4. Νουκλεοτίδια
Τρία νουκλεοτίδια, ουριδίνη-5′-μονοφωσφορική (UMP), αδενοσίνη-5′-μονοφωσφορική (ΑΜΡ), και γουανοσίνη-5′-μονοφωσφορική (GMP), διαχωρίστηκαν με μέθοδο που αναπτύχθηκε από τον Yang et al. [17]. Υπό φαρμακολογικής άποψης, τα νουκλεοτίδια έχουν αναφερθεί ότι ενισχύουν την ανοσολογική αντίδραση, επηρεάζουν το μεταβολισμό των λιπαρών οξέων, βοηθάνε την απορρόφηση του σιδήρου από το έντερο και βελτιώνουν την γαστρεντερική βλάβη [17, 48]. Τα νουκλεοτίδια ΑΜΡ, GMP, και UMP μπορεί να αποδοθούν απλά ως αδενοσίνη, γουανοσίνη και ουριδίνη, αντίστοιχα.
Τα νουκλεοτίδια μπορούν να αναστείλουν την φλεγμονή ουρήθρας, να προάγουν την κυκλοφορία του αίματος, και να βελτιώσουν την λειτουργία του εγκεφάλου, και η πιο σημαντική δράση τους είναι στην ενίσχυση του ανθρώπινου ανοσοποιητικού, το οποίο έχει αναφερθεί σε προηγούμενες μελέτες [49].
2.2. Πολυσακχαρίτες
Το Κόρντισεπς Σίνενσις περιέχει πολλούς πολυσακχαρίτες, οι οποίοι μπορούν να κυμαίνονται από 3% έως 8% του συνολικού βάρους [50, 51]. Οι πολυσακχαρίτες του Κόρντισεπς περιλαμβάνουν κυρίως εξωκυτταρικούς πολυσακχαρίτες και ενδοκυτταρικούς πολυσακχαρίτες.
Ένα μεγάλο μέρος πειραματικών αποδείξεων έχει δείξει ότι οι πολυσακχαρίτες μανιταριών έχουν ένα ευρύ φάσμα σε βιοδραστικότητες συμπεριλαμβανομένων: αντικαρκινική [52], ενάντια στο ιό της γρίππης [53], ανοσοενίσχυση [54], υπογλυκαιμική [55], υποχοληστερολαιμική [56] και αντιοξειδωτική [ 51].
Οι πολυσακχαρίτες αποτελούν την κύρια συνεισφορά προς τις φαρμακολογικές ιδιότητες του Κόρντισεπς Σίνενσις. Παρ ‘όλα αυτά, η εφαρμογή τους έχει περιοριστεί μέχρι στιγμής, λόγω της περιορισμένης προσφοράς του. Είναι ένα είδος απειλούμενο με εξαφάνιση λόγω της υπερβολικής συγκομιδής του φυσικού μύκητα [59, 60]. Εν τω μεταξύ, τα καλλιεργημένα Κόρντισεπς Σίνενσις έχουν δείξει όλες τις φαρμακολογικές ιδιότητες που παρουσιάζει και το φυσικό Κόρντισεπς Σίνενσις [50].
2.2.1. EPSF
To κλάσμα εξωπολυσακχαρίτη (EPSF), ένας ετεροπολυσακχαρίτης έχει έναν μεγάλο αριθμό από φαρμακολογικές επιδράσεις, δύο από τις πιο σημαντικές είναι οι ανοσοτροποποιητικές και οι αντικαρκινικές [61]. Προηγούμενες μελέτες έχουν δείξει ότι ο EPSF θα μπορούσε να σαρώνει τις ελεύθερες ρίζες, να επάγει την διαφοροποίηση των καρκινικών κυττάρων και να ενισχύει την αντικαρκινική ικανότητα μέσω ενεργοποίησης διαφορετικών ανοσοαποκρίσεων στον ξενιστή [61].
Όπως αναφέρθηκε παραπάνω, ο EPSF μπορεί να αναστείλλει πολλά διαφορετικά καρκινικά κύτταρα. Επιπλέον, ίσως ενισχύει την αντινεοπλασματική ικανότητα ζώων ή ανθρώπων μέσω της ενεργοποίησης διαφορετικών ανοσοαποκρίσεων στον ξενιστή.
Ο EPS-1 σε μια πρόσφατη μελέτη έδειξε ότι θειωμένα EPS-1 παράγωγα έχουν αξιοσημείωτη αντιοξειδωτική δραστικότητα.
2.2.2. APS
Ένας πολυσακχαρίτης (APS) απομονώθηκε από καλλιεργούμενα μυκήλια Κόρντισεπς Σίνενσις [66]. Ο APS έχει προστατευτικά αποτελέσματα σε PC12 κύτταρα έναντι της Η2Ο2 προκαλούμενης ζημίας [67]. Ωστόσο, ο αντιοξειδωτικός μηχανισμός του APS παραμένει ασαφής και χρειάζεται περαιτέρω διερεύνηση.
Δεδομένου ότι κλάσμα του πολυσακχαρίτη (APSF) έχει διεγερτικές επιδράσεις επί των μακροφάγων [68], οι Chen et al. έχουν αποδείξει ότι ο APSF ίσως μετατρέπει τα M2 μακροφάγα σε Μ1 φαινότυπο μέσω ενεργοποίησης της NF-κΒ οδού. Συνεπώς, ο APSF έχει, επίσης, ανοσορρυθμιστικές επιδράσεις, όπως πολλοί άλλοι πολυσακχαρίτες [69].
2.2.3. CPS-1
Μελέτες έχουν αποδείξει ότι ένας υδατοδιαλυτός πολυσακχαρίτης που ονομάζεται CPS-1 είχε ισχυρές αντιοξειδωτικές δράσεις, οι οποίες μπορουν να χρησιμοποιηθούν για την μείωση του επιπέδου γλυκόζης στο αίμα [71] και την αντιμετώπιση της νεφρικής ανεπάρκειας [70].
Από την μία πλευρά, ο CPS-1 έδειξε μια σύνδεση μεταξύ αντιοξειδωτικής δράση και αποκατάστασης της νεφρικής ανεπάρκειας. Από την άλλη πλευρά, ο CPS-1 διεγείρει την παγκρεατική απελευθέρωση ινσουλίνης και / ή μειώνει τον μεταβολισμό της ινσουλίνης, έτσι ώστε ο πολυσακχαρίτης να μπορεί να αντιμετωπίσει τον διαβήτη. Ειδικά, η αναγωγική ισχύς του CPS-1 ήταν πολύ ισχυρή και σχεδόν τόσο αποτελεσματική όσο το ασκορβικό οξύ [71].
2.2.4. CPS-2
O πολυσακχαρίτης CPS-2 έχει αποδειχθεί ότι έχει σημαντική ιαματική δράση κατά της χρόνιας νεφρικής ανεπάρκειας. Πρόσφατα, ο υποκείμενος μοριακός μηχανισμός του έχει διερευνηθεί από επιστήμονες. Οι Wang et al. βρήκαν ότι το CPS-2 θα μπορούσε να μειώσει τον πολλαπλασιασμό των επαγόμενων κυττάρων PDGF-ΒΒ μέσω των οδών PDGF / ERK και ΤGF-b1/ Smad [73]. Ως αποτέλεσμα, o CPS-2 αναστέλλει τον πολλαπλασιασμό των PDGF-ΒΒ-επαγόμενων ανθρώπινων μεσαγγειακών κυττάρων (HMCS) με δοσο-εξαρτώμενο τρόπο.
2.3. Στερόλες
Οι στερόλες έχουν σημαντική φυσιολογική λειτουργία. Έχουν, επίσης, μια ποικιλία βιολογικών δράσεων. Συνεπώς, η μέλετη για τις στερόλες έχει σημαντική, θεωρητική σημασία και προοπτικές εφαρμογής.
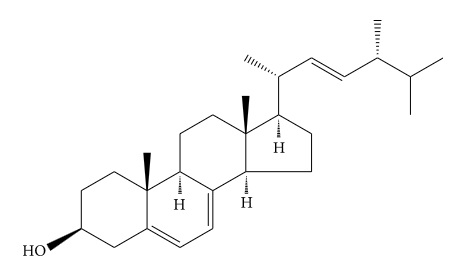
 2.3.1. Εργοστερόλη
2.3.1. Εργοστερόλη
Η εργοστερόλη (Εικόνα 4) είναι ένα χαρακτηριστικό της στερόλης των μανιταριών και μια σημαντική πηγή βιταμίνης D2 [78]. Η εργοστερόλη δεν έλαβε αρκετή προσοχή στη μελέτη του Κόρντισεπς Σίνενσις παρόλο των χαρακτηριστικών της [79]. Οι Υ H. Li και Χ L. Li προσδιόρισαν ότι η εργοστερόλη υπήρχε σε ελεύθερη και συνδυαστική κατάσταση [80].
Είναι σημαντικό ότι η εργοστερόλη είναι ένα τρόφιμο και μία φαρμακευτική πρώτη ύλη. Επιπρόσθετα, είναι μία σημαντική πρώτη ύλη για την παραγωγή στεροειδών ορμονικών φαρμάκων [81].
Οι Zheng et al. έχουν αποδείξει την κυτταροτοξικότητα και την αντιμικροβιακή δράση της εργοστερόλης, διαθέτει αδύναμη κυτταροτοξικότητα εναντία σε HL-60 και BEL-7402 κυτταρικές γραμμές και μέτρια αντιμικροβιακή δράση έναντια των βακτηρίων E. aerogenes και P. aeruginosa και του μύκητα Candida albicans [82].
 2.3.2. H1-A
2.3.2. H1-A
Η H1-Α (Εικόνα 5) είναι μια καθαρή ένωση που χρησιμοποιείται στην παραδοσιακή κινεζική ιατρική. Για να διευκρινιστούν οι φαρμακολογικές ιδιότητες της Η1-Α, μία σειρά από έρευνες μελέτησαν την επίδραση στον μεσαγγειακό κυτταρικό πολλαπλασιασμό, στην κυτταροτοξικότητα, στους κυτταρικούς κύκλους και στην απόπτωση.
Τα ευρήματα υποδηλώνουν ότι η Η1-Α ρυθμίζει ορισμένα υποκυτταρικά μονοπάτια μεταγωγής σήματος και αλλάζει η ισορροπία μεταξύ πολλαπλασιασμού και απόπτωσης των μεσαγγειακών κυττάρων in vitro ή in vivo. Η Η1-Α ίσως είναι αποτελεσματική στην αντιμετώπιση αυτοάνοσων διαταραχών, και η διαμόρφωση της μεταγωγής σήματος των πρωτεϊνών Bcl-2 και Bcl-XL ίσως αντιπροσωπεύει ένα στόχο για μελλοντικές φαρμακολογικές παρεμβάσεις [84]. Εν τω μεταξύ, η Η1-Α μπορεί να καταστείλει το ενεργοποιημένο HMC και να ανακουφίσει το IgΑΝ (νόσος Berger) με κλινική και ιστολογική βελτίωση. Οι Lin et al. προέβλεψαν ότι η Η1-Α ως ένα ιαματικό σχήμα θα μπορούσε να χρησιμοποιηθεί στο μέλλον [86].
2.4. Πρωτεΐνη
Οι περισσότερες πρωτεΐνες του Κόρντισεπς Σίνενσις είναι ένζυμα, συμπεριλαμβανομένων των ενδοκυτταρικών πρωτεασών και των εξωκυτταρικών πρωτεασών.
2.4.1. CSDNase
Μία νέα δεοξυριβονουκλεάση (DNase) εξήχθη από το Κόρνισεπς Σίνενσις και χαρακτηρίστηκε ως CSDNase. Παρόλο που η DNase αρχικά μελετήθηκε βιοχημικά τη δεκαετία του 1960 [89], η δομή της δεν έχει ακόμα διευκρινιστεί. Οι δεοξυριβονουκλεάσεις μπορούν γενικά να χωριστούν σε δύο κατηγορίες: την DNase Ι και την DNase ΙΙ. Η CSDNase ανήκει στην τελευταία.
Η δραστικότητα της CSDNase εκφράστηκε κυρίως κατά τη διάρκεια ανάπτυξης από το μυκήλιο και ήταν ένα ενδοκυτταρικό ένζυμο [90]. Επιπλέον, η CSDNase ήταν μια ενδονουκλεάση, η οποία βρέθηκε να υδρολύει το DNA και να παράγει 3-φωσφορικά και 5-ΟΗ άκρα. Αυτά τα αποτελέσματα έδειξαν ότι οι νουκλεολυτικές ιδιότητες της CSDNase ήταν ουσιαστικά οι ίδιες με άλλες καλά τεκμηριωμένες δεοξυριβονουκλεάσες
2.4.2. CSP
Μια νέα πρωτεάση σερίνης με ινολυτική δραστηριότητα, ονομάστηκε CSP που είναι μία απλή αλυσίδα πολυπεπτιδίων με μοριακό βάρος 31 kD.
Οι Li et al βρήκαν ότι η παρουσία του CSP ενδεχομένως συνδέει το Κόρντισεπς Σίνενσις με την φαρμακολογική χρήση του σε καρδιαγγειακή διαταραχή, η οποία θα προσφέρει μια νέα εικόνα για την κατασκευή πρωτεϊνών για νέα θρομβολυτικά φάρμακα [91].
2.5. Αμινοξέα και Πολυπεπτιδία
Το Κόρντισεπς Σίνενσις περιέχει πολλά αμινοξέα και πολυπεπτίδια, τα οποία έπαιξαν σημαντικό ρόλο σε κλινικές δοκιμές και θα μπορούσαν να χρησιμοποιηθούν για την αντιμετώπιση της υπέρτασης. Ως αποτέλεσμα, είναι απαραίτητο να διερευνηθούν οι φαρμακολογικές επιδράσεις των αμινοξέων και των πολυπεπτιδίων στο Κόρντισεπς Σίνενσις
2.5.1. Κορντιμίνη
Η Κορντιμίνη είναι ένα πεπτίδιο από το φαρμακευτικό μανιτάρι Κόρντισεπς Σίνενσις και τα ευρήματα έδειξαν μια σημαντική εξέλιξη για την αντιμετώπισης της διαβητικής οστεοπενίας.
2.5.2. Κορντισεδιπεπτίδιο A
Ένα νέο κυκλοδιπεπτίδιο με το όνομα κορντισεδιπεπτίδιο Α απομονώθηκε από το Κόρντισεπς Σίνενσις. Οι Jia et al. έχουν αναφέρει ότι παρουσιάζει κυτταροτοξικές δράσεις σε L-929, Α375 και Hela και την καλύτερη επίδραση του σε διάφορες καρκινικές κυτταρικές σειρές [96]. Ωστόσο, απομένει να διερευνηστεί περαιτέρω
2.5.3. Κορντισεαμίδια A και B
Προηγούμενες μελέτες πρότειναν ότι τόσο το Κορντισεαμίδιο Α αλλά και το Κορντισεαμίδιο Β είχαν κυτταροτοξικά αποτελέσματα επί L929, Α375 και HeLa κυτταρικές σειρές [97].
2.5.4. Τρυπτοφάνη
Υπάρχουν 18 είδη αμινοξέων στο Κόρντισεπς Σίνενσις και κυρίως έχουν ένα ηρεμιστικό υπνωτικό αποτέλεσμα. Ανάμεσα τους, η τρυπτοφάνη είναι το πιο αποτελεσματικό συστατικό. Η τρυπτοφάνη είναι ο πρόδρομος του υλικού της σεροτονίνης, το οποίο έχει στενή σχέση με την αϋπνία ζώων [98]. Το γλουταμινικό οξύ έχει ως αποτέλεσμα την ανοσολογική αναστολή. Λόγω του ότι η απόδοση του συνδυασμένου αποτελέσματος είναι πιο περίπλοκη, περισσότερη έρευνα χρειάζεται για να διερευνηθεί.
2.6. Άλλα συστατικά
Το Κόρντισεπς Σίνενσις περιέχει μεγάλες ποσότητες D-μαννιτόλη, επίσης γνωστή ως κορντισεπικό οξύ. Το Κορντισεπικό οξύ διαδραμάτισε σημαντικό ρόλο στην αντιμετώπιση της ηπατικής ίνωσης σε ηπατικά αστεροειδή κύτταρα. Η ηπατική ίνωση είναι μια ποικιλία παραγόντων που εμπλέκονται σε μία πολύπλοκη διαδικασία [100]. Το Κορντισεπικό οξύ βελτιώνει τον επαγόμενο από LPS φλεγμονώδη φαινότυπο και την TGFβ1 επαγόμενη ινογόνο απόκριση των καλλιεργημένων HSCs, τα οποία είναι ιαματικοί μηχανισμοί του φαρμάκου για να αναστέλλει και να επιλύει την ηπατική ίνωση [101].
Επιπλέον, το Κορντισεπικό οξύ στο Κόρντισεπς Σίνενσις έχει επιδράσεις στο διουρητικό, βελτιώνοντας την οσμωτική πίεση του πλάσματος και την δράση ενάντια στις ελεύθερες ρίζες, σύμφωνα με φαρμακολογική έρευνα και κλινικές αναφορές [102, 103]. Ως εκ τούτου, θεωρείται ως ένα από τα δραστικά συστατικά στο Κόρντισεπς Σίνενσις.
Ένας νέος μονοσακχαρίτης, η σαπωνίνη, απομονώθηκε από τα μυκήλια του Κόρντισεπς Σίνενσις. Εμφάνισε πολύ καλή δραστικότητα ενάντια του όγκου αλλά το περιεχόμενο της στα μυκήλια ήταν πολύ χαμηλό [104].
Επιπλέον, υπάρχουν πολλά άλλα συστατικά στο μανιτάρι Κόρντισεπς Σίνενσις, για παράδειγμα, αλκάνια, πολυαμίνες, βιταμίνες και μικροστοιχεία. Κάθε ένα από αυτά έχει τις δικές φαρμακολογικές επιδράσεις του. Ωστόσο, περισσότερα συστατικά χρειάζεται να διαχωριστούν και να μελετηθούν σε μελλοντικές ερευνητικές εργασίες
3. Συμπέρασμα
Το Κόρντισεπς Σίνενσις, ένας μακρομύκητας βιοφαρμακευτικής σημασίας, περιέχει μια σειρά βιοενεργών συστατικών (Πίνακας 1). Πολλά από αυτά είναι τροποποιητές της βιολογικής απόκρισης που ενεργοποιούν το ανοσοποιητικό μας σύστημα για ένα πλήθος αμυντικών λειτουργιών.
Οι ανοσοτροποποιητικές επιδράσεις σχετίζονται με αντικαρκινική δραστηριότητα, η οποία είναι η πλέον παροιμιώδης επίδραση του Κόρντισεπς Σίνενσις. Πολλά συστατικά στο Κόρντισεπς Σίνενσις έχουν αντικαρκινική δραστικότητα όπως η Κορντισεπίνη, η αδενοσίνη, ο EPSF, οι Κορντιγλυκάνες και οι μονοσακχαρίτες σαπωνίνες.
Καθώς η έρευνα για αυτόν τον μύκητα συνεχίζεται, περισσότερα βιοδραστικά συστατικά με δυνητική ιαματική αξία θα απομονωθούν. Ωστόσο, νέες μεθόδοι και νέες τεχνολογίες χρειάζεται να υιοθετηθούν για να εξαχθούν και να αναλυθούν τα στοιχεία, που απαιτούν αξιολόγηση σύμφωνα με την σύγχρονη επιστημονική γραμμή .
Συνολικά, μέχρι στιγμής, γνωρίζουμε μόνο λίγα από τα θαυμαστά αυτής της τροφής και εξακολουθεί να έχει πολλά ακόμα μυστικά για να ανακαλύψουμε. Απαιτείται περισσότερη έρευνα για την φυτική ιατρική και τα συναφή είδη της.
Πίνακας 1: Χημικά συστατικά και οι αντίστοιχες φαρμακολογικές δράσεις του Κόρντισεπς Σίνενσις
CPS-1
CPS-2
Μαννογλυκάνη
CME-1
Κορντιγλυκάνες
CS-F10
Κορντισινοκάνη
Εργοστερόλη
H1-A
CSDNase
CSP
Κορντιμίνη
Τριπτοφάνη
Κορντισεπικό οξύ
Μονοσακχαρίτες σαπωνίνες Αντικαρκινική δράση
———
Επιμέλεια – Μετάφραση: «Blog για τα Κόρντισεπς»
[toggle title="Παραπομπές"]
1. J. H. Xiao, Y. Qi, and Q. Xiong, “Nucleosides, a valuable chemical marker for quality control in traditional Chinese medicine Cordyceps,” Recent Patents on Biotechnology, vol. 7, no. 2, pp. 153–166, 2013.
2. T. B. Ng and H. X. Wang, “Pharmacological actions of Cordyceps, a prized folk medicine,” The Journal of Pharmacy and Pharmacology, vol. 57, no. 12, pp. 1509–1519, 2005.
3. B. Shrestha and J.-M. Sung, “Notes on Cordyceps species collected from the central region of Nepal,” Mycobiology, vol. 33, no. 4, pp. 235–239, 2005.
4. K. L. Wong, E. C. So, C. C. Chen, R. S. C. Wu, and B.-M. Huang, “Regulation of steroidogenesis by Cordyceps sinensis mycelium extracted fractions with (hCG) treatment in mouse Leydig cells,” Archives of Andrology, vol. 53, no. 2, pp. 75–77, 2007.
5. H. M. Yu, B.-S. Wang, S. C. Huang, and P.-D. Duh, “Comparison of protective effects between cultured Cordyceps militaris and natural Cordyceps sinensis against oxidative damage,” Journal of Agricultural and Food Chemistry, vol. 54, no. 8, pp. 3132–3138, 2006.
6. K. Yue, M. Ye, Z. Zhou, W. Sun, and X. Lin, “The genus Cordyceps: a chemical and pharmacological review,” Journal of Pharmacy and Pharmacology, vol. 65, no. 4, pp. 474–493, 2013.
7. H. S. Tuli, A. K. Sharma, S. S. Sandhu, and D. Kashyap, “Cordycepin: a bioactive metabolite with therapeutic potential,” Life Sciences, vol. 93, no. 23, pp. 863–869, 2013.
8. F. Zhong, X. Liu, Q. Zhou et al., “1H NMR spectroscopy analysis of metabolites in the kidneys provides new insight into pathophysiological mechanisms: applications for treatment with Cordyceps sinensis,” Nephrology Dialysis Transplantation, vol. 27, no. 2, pp. 556–565, 2012.
9. C.-F. Kuo, C.-C. Chen, C.-F. Lin et al., “Abrogation of streptococcal pyrogenic exotoxin B-mediated suppression of phagocytosis in U937 cells by Cordyceps sinensis mycelium via production of cytokines,” Food and Chemical Toxicology, vol. 45, no. 2, pp. 278–285, 2007.
10. Y.-C. Chen, Y.-L. Huang, and B.-M. Huang, “Cordyceps sinensis mycelium activates PKA and PKC signal pathways to stimulate steroidogenesis in MA-10 mouse Leydig tumor cells,” The International Journal of Biochemistry and Cell Biology, vol. 37, no. 1, pp. 214–223, 2005.
11. N. Yamaguchi, J. Yoshida, L. J. Ren et al., “Augmentation of various immune reactivities of tumor-bearing hosts with an extract of Cordyceps sinensis,” Biotherapy, vol. 2, no. 3, pp. 199–205, 1990.
12. H.-C. Lo, T.-H. Hsu, S.-T. Tu, and K.-C. Lin, “Anti-hyperglycemic activity of natural and fermented Cordyceps sinensis in rats with diabetes induced by nicotinamide and streptozotocin,” The American Journal of Chinese Medicine, vol. 34, no. 5, pp. 819–832, 2006.
13. K. Nakamura, K. Konoha, Y. Yamaguchi, S. Kagota, K. Shinozuka, and M. Kunitomo, “Combined effects of Cordyceps sinensis and methotrexate on hematogenic lung metastasis in mice,” Receptors and Channels, vol. 9, no. 5, pp. 329–334, 2003.
14. J. L. Jordan, G. M. Hirsch, and T. D. G. Lee, “C. sinensis ablates allograft vasculopathy when used as an adjuvant therapy with cyclosporin A,” Transplant Immunology, vol. 19, no. 3-4, pp. 159–166, 2008.
15. R. Ikeda, M. Nishimura, Y. Sun, M. Wada, and K. Nakashima, “Simple HPLC-UV determination of nucleosides and its application to the authentication of Cordyceps and its allies,” Biomedical Chromatography, vol. 22, no. 6, pp. 630–636, 2008.
16. J. Guan, J. Zhao, K. Feng, D.-J. Hu, and S.-P. Li, “Comparison and characterization of polysaccharides from natural and cultured Cordyceps using saccharide mapping,” Analytical and Bioanalytical Chemistry, vol. 399, no. 10, pp. 3465–3474, 2011.
17. F. Q. Yang, D. Q. Li, K. Feng, D. J. Hu, and S. P. Li, “Determination of nucleotides, nucleosides and their transformation products in Cordyceps by ion-pairing reversed-phase liquid chromatography-mass spectrometry,” Journal of Chromatography A, vol. 1217, no. 34, pp. 5501–5510, 2010.
18. T. Furuya, M. Hirotani, and M. Matsuzawa, “A study on the composition of Cordyceps militaris extract and mycelium,” Phytochemistry, vol. 22, pp. 2509–2512, 1983.
19. C.-H. Dong and Y.-J. Yao, “Nutritional requirements of mycelial growth of Cordyceps sinensis in submerged culture,” Journal of Applied Microbiology, vol. 99, no. 3, pp. 483–492, 2005.
20. F. Q. Yang, J. Guan, and S. P. Li, “Fast simultaneous determination of 14 nucleosides and nucleobases in cultured Cordyceps using ultra-performance liquid chromatography,” Talanta, vol. 73, no. 2, pp. 269–273, 2007.
21. R. R. M. Paterson, “Cordyceps—a traditional Chinese medicine and another fungal therapeutic biofactory?” Phytochemistry, vol. 69, no. 7, pp. 1469–1495, 2008.
22. R. Ikeda, M. Nishimura, Y. Sun, M. Wada, and K. Nakashima, “Simple HPLC-UV determination of nucleosides and its application to the authentication of Cordyceps and its allies,” Biomedical Chromatography, vol. 22, no. 6, pp. 630–636, 2008.
23. J. Wang, Y.-M. Liu, W. Cao, K.-W. Yao, Z.-Q. Liu, and J.-Y. Guo, “Anti-inflammation and antioxidant effect of cordymin, a peptide purified from the medicinal mushroom Cordyceps sinensis, in middle cerebral artery occlusion-induced focal cerebral ischemia in rats,” Metabolic Brain Disease, vol. 27, no. 2, pp. 159–165, 2012.
24. X. Z. Ying, L. Peng, H. Chen, Y. Shen, K. Yu, and S. Cheng, “Cordycepin prevented IL-β-induced expression of inflammatory mediators in human osteoarthritis chondrocytes,” International Orthopaedics, vol. 38, no. 7, pp. 1519–1526, 2014.
25. E.-S. Park, D.-H. Kang, M.-K. Yang et al., “Cordycepin, 3′-deoxyadenosine, prevents rat hearts from ischemia/reperfusion injury via activation of Akt/GSK-3β/p70S6K signaling pathway and HO-1 expression,” Cardiovascular Toxicology, vol. 14, no. 1, pp. 1–9, 2014.
26. G.-M. Qian, G.-F. Pan, and J.-Y. Guo, “Anti-inflammatory and antinociceptive effects of cordymin, a peptide purified from the medicinal mushroom Cordyceps sinensis,” Natural Product Research, vol. 26, no. 24, pp. 2358–2362, 2012.
27. B.-S. Pan, C.-Y. Lin, and B.-M. Huang, “The effect of cordycepin on steroidogenesis and apoptosis in MA-10 mouse Leydig tumor cells,” Evidence-Based Complementary and Alternative Medicine, vol. 2011, Article ID 750468, 14 pages, 2011.
28. S.-F. Leu, S. L. Poon, H.-Y. Pao, and B.-M. Huang, “The in vivo and in vitro stimulatory effects of cordycepin on mouse Leydig cell steroidogenesis,” Bioscience, Biotechnology and Biochemistry, vol. 75, no. 4, pp. 723–731, 2011.
29. H. Y. Pao, B. S. Pan, S. F. Leu, and B. M. Huang, “Cordycepin stimulated steroidogenesis in MA-10 mouse Leydig tumor cells through the protein kinase C pathway,” Journal of Agricultural and Food Chemistry, vol. 60, no. 19, pp. 4905–4913, 2012.
30. X. X. Zhou, L. P. Luo, W. K. Dressel et al., “Cordycepin is an immunoregulatory active ingredient of Cordyceps sinensis,” The American Journal of Chinese Medicine, vol. 36, no. 5, pp. 967–980, 2008.
31. F. Q. Yang, S. P. Li, P. Li, and Y. T. Wang, “Optimization of CEC for simultaneous determination of eleven nucleosides and nucleobases in Cordyceps using central composite design,” Electrophoresis, vol. 28, no. 11, pp. 1681–1688, 2007.
32. F.-Q. Yang, L. Ge, J. W. H. Yong, S. N. Tan, and S.-P. Li, “Determination of nucleosides and nucleobases in different species of Cordyceps by capillary electrophoresis-mass spectrometry,” Journal of Pharmaceutical and Biomedical Analysis, vol. 50, no. 3, pp. 307–314, 2009.
33. L.-F. Huang, Y.-Z. Liang, F.-Q. Guo, Z.-F. Zhou, and B.-M. Cheng, “Simultaneous separation and determination of active components in Cordyceps sinensis and Cordyceps militarris by LC/ESI-MS,” Journal of Pharmaceutical and Biomedical Analysis, vol. 33, no. 5, pp. 1155–1162, 2003.
34. F. Q. Yang and S. P. Li, “Effects of sample preparation methods on the quantification of nucleosides in natural and cultured Cordyceps,” Journal of Pharmaceutical and Biomedical Analysis, vol. 48, no. 1, pp. 231–235, 2008.
35. M. Kitakaze and M. Hori, “Adenosine therapy: a new approach to chronic heart failure,” Expert Opinion on Investigational Drugs, vol. 9, no. 11, pp. 2519–2535, 2000.
36. S. Nakav, C. Chaimovitz, Y. Sufaro et al., “Anti-inflammatory preconditioning by agonists of adenosine A1 receptor,” PLoS ONE, vol. 3, no. 5, Article ID e2107, 2008.
37. J. P. Manfredi and H. V. Sparks Jr., “Adenosine’s role in coronary vasodilation induced by atrial pacing and norepinephrine,” The American Journal of Physiology—Endocrinology and Metabolism, vol. 243, no. 4, pp. H536–H545, 1982.
38. J. Ontyd and J. Schrader, “Measurement of adenosine, inosine, and hypoxanthine in human plasma,” Journal of Chromatography, vol. 307, no. 2, pp. 404–409, 1984.
39. Y.-J. Tsai, L.-C. Lin, and T.-H. Tsai, “Pharmacokinetics of adenosine and cordycepin, a bioactive constituent of Cordyceps sinensis in rat,” Journal of Agricultural and Food Chemistry, vol. 58, no. 8, pp. 4638–4643, 2010.
40. D. Yang, T. Yaguchi, H. Yamamoto, and T. Nishizaki, “Intracellularly transported adenosine induces apoptosis in HuH-7 human hepatoma cells by downregulating c-FLIP expression causing caspase-3/-8 activation,” Biochemical Pharmacology, vol. 73, no. 10, pp. 1665–1675, 2007.
41. D. Yang, T. Yaguchi, C.-R. Lim, Y. Ishizawa, T. Nakano, and T. Nishizaki, “Tuning of apoptosis-mediator gene transcription in HepG2 human hepatoma cells through an adenosine signal,” Cancer Letters, vol. 291, no. 2, pp. 225–229, 2010.
42. Y. F. Ma, J. Zhang, Q. Zhang et al., “Adenosine induces apoptosis in human liver cancer cells through ROS production and mitochondrial dysfunction,” Biochemical and Biophysical Research Communications, vol. 448, no. 1, pp. 8–14, 2014.
43. R. Iannone, L. Miele, P. Maiolino, A. Pinto, and S. Morello, “Adenosine limits the therapeutic effectiveness of anti-CTLA4 mAb in a mouse melanoma model,” American Journal of Cancer Research, vol. 4, no. 2, pp. 172–181, 2014.
44. S. Gessi, S. Merighi, and P. A. Borea, “Targeting adenosine receptors to prevent inflammatory skin diseases,” Experimental Dermatology, vol. 23, no. 8, pp. 553–554, 2014.
45. J. E. Coelho, P. Alves, P. M. Canas, et al., “Overexpression of adenosine A2A receptors in rats: effects on depression, locomotion, and anxiety,” Frontiers in Psychiatry, vol. 5, article 67, 2014.
46. H. Fan, F. Q. Yang, and S. P. Li, “Determination of purine and pyrimidine bases in natural and cultured Cordyceps using optimum acid hydrolysis followed by high performance liquid chromatography,” Journal of Pharmaceutical and Biomedical Analysis, vol. 45, no. 1, pp. 141–144, 2007.
47. W. Struck-Lewicka, R. Kaliszan, and M. J. Markuszewski, “Analysis of urinary nucleosides as potential cancer markers determined using LC-MS technique,” Journal of Pharmaceutical and Biomedical Analysis, vol. 101, pp. 50–57, 2014.
48. S. P. Li, “The nucleosides contents and their variation in natural Cordyceps sinensis and cultured Cordyceps mycelia,” Journal of Chinese Pharmaceutical Sciences, vol. 10, pp. 175–179, 2001.
49. X. Zhou, Z. Gong, Y. Su, J. Lin, and K. Tang, “Cordyceps fungi: natural products, pharmacological functions and developmental products,” Journal of Pharmacy and Pharmacology, vol. 61, no. 3, pp. 279–291, 2009.
50. S. P. Li, P. Li, T. T. X. Dong, and K. W. K. Tsim, “Anti-oxidation activity of different types of natural Cordyceps sinensis and cultured Cordyceps mycelia,” Phytomedicine, vol. 8, no. 3, pp. 207–212, 2001.
51. S. P. Li, Z. R. Su, T. T. X. Dong, and K. W. K. Tsim, “The fruiting body and its caterpillar host of Cordyceps sinensis show close resemblance in main constituents and anti-oxidation activity,” Phytomedicine, vol. 9, no. 4, pp. 319–324, 2002.
52. Y.-J. Chen, M.-S. Shiao, S.-S. Lee, and S.-Y. Wang, “Effect of Cordyceps sinensis on the proliferation and differentiation of human leukemic U937 cells,” Life Sciences, vol. 60, no. 25, pp. 2349–2359, 1997.
53. Y. Ohta, J.-B. Lee, K. Hayashi, A. Fujita, K. P. Dong, and T. Hayashi, “In vivo anti-influenza virus activity of an immunomodulatory acidic polysaccharide isolated from Cordyceps militaris grown on germinated soybeans,” Journal of Agricultural and Food Chemistry, vol. 55, no. 25, pp. 10194–10199, 2007.
54. K. Nakamura, Y. Yamaguchi, S. Kagota, K. Shinozuka, and M. Kunitomo, “Activation of in vivo Kupffer cell function by oral administration of Cordyceps sinensis in rats,” The Japanese Journal of Pharmacology, vol. 79, no. 4, pp. 505–508, 1999.
55. T. Kiho, K. Ookubo, S. Usui, S. Ukai, and K. Hirano, “Structural features and hypoglycemic activity of a polysaccharide (CS- F10) from the cultured mycelium of Cordyceps sinensis,” Biological and Pharmaceutical Bulletin, vol. 22, no. 9, pp. 966–970, 1999.
56. J.-H. Koh, J.-M. Kim, U.-J. Chang, and H.-J. Suh, “Hypocholesterolemic effect of hot-water extract from mycelia of Cordyceps sinensis,” Biological and Pharmaceutical Bulletin, vol. 26, no. 1, pp. 84–87, 2003.
57. X. Zhou, Z. Gong, Y. Su, J. Lin, and K. Tang, “Cordyceps fungi: natural products, pharmacological functions and developmental products,” Journal of Pharmacy and Pharmacology, vol. 61, no. 3, pp. 279–291, 2009.
58. J. Guan, F.-Q. Yang, and S.-P. Li, “Evaluation of carbohydrates in natural and cultured Cordyceps by pressurized liquid extraction and gas chromatography coupled with mass spectrometry,” Molecules, vol. 15, no. 6, pp. 4227–4241, 2010.
59. J. Chen, W. Zhang, T. Lu, J. Li, Y. Zheng, and L. Kong, “Morphological and genetic characterization of a cultivated Cordyceps sinensis fungus and its polysaccharide component possessing antioxidant property in H22 tumor-bearing mice,” Life Sciences, vol. 78, no. 23, pp. 2742–2748, 2006.
60. W. Zhang, J. Li, S. Qiu, J. Chen, and Y. Zheng, “Effects of the exopolysaccharide fraction (EPSF) from a cultivated Cordyceps sinensis on immunocytes of H22 tumor bearing mice,” Fitoterapia, vol. 79, no. 3, pp. 168–173, 2008.
61. L. Sheng, J. Chen, J. Li, and W. Zhang, “An exopolysaccharide from cultivated Cordyceps sinensis and its effects on cytokine expressions of immunocytes,” Applied Biochemistry and Biotechnology, vol. 163, no. 5, pp. 669–678, 2011.
62. M. Movassagh, A. Spatz, J. Davoust et al., “Selective accumulation of mature DC-Lamp + dendritic cells in tumor sites is associated with efficient T-cell-mediated antitumor response and control of metastatic dissemination in melanoma,” Cancer Research, vol. 64, no. 6, pp. 2192–2198, 2004.
63. D. Song, J. Y. Lin, F. J. Yuan, and W. Zhang, “Ex vivo stimulation of murine dendritic cells by an exopolysaccharide from one of the anamorph of Cordyceps sinensis,” Cell Biochemistry and Function, vol. 29, no. 7, pp. 555–561, 2011.
64. J. Yang, W. Zhang, P. Shi, J. Chen, X. Han, and Y. Wang, “Effects of exopolysaccharide fraction (EPSF) from a cultivated Cordyceps sinensis fungus on c-Myc, c-Fos, and VEGF expression in B16 melanoma-bearing mice,” Pathology Research and Practice, vol. 201, no. 11, pp. 745–750, 2005.
65. J. K. Yan, W. Q. Wang, H. L. Ma, and J. Y. Wu, “Sulfation and enhanced antioxidant capacity of an exopolysaccharide produced by the medicinal fungus Cordyceps sinensis,” Molecules, vol. 18, no. 1, pp. 167–177, 2013.
66. W. B. Shen, D. Song, J. Y. Wu, and W. Zhang, “Protective effect of a polysaccharide isolated from a cultivated Cordyceps mycelia on hydrogen peroxide-induced oxidative damage in PC12 cells,” Phytotherapy Research, vol. 25, no. 5, pp. 675–680, 2011.
67. S. P. Li, K. J. Zhao, Z. N. Ji et al., “A polysaccharide isolated from Cordyceps sinensis, a traditional Chinese medicine, protects PC12 cells against hydrogen peroxide-induced injury,” Life Sciences, vol. 73, no. 19, pp. 2503–2513, 2003.
68. W. Chen, W. Zhang, W. Shen, and K. Wang, “Effects of the acid polysaccharide fraction isolated from a cultivated Cordyceps sinensis on macrophages in vitro,” Cellular Immunology, vol. 262, no. 1, pp. 69–74, 2010.
69. W. Chen, F. Yuan, K. Wang, D. Song, and W. Zhang, “Modulatory effects of the acid polysaccharide fraction from one of anamorph of Cordyceps sinensis on Ana-1 cells,” Journal of Ethnopharmacology, vol. 142, no. 3, pp. 739–745, 2012.
70. Y. Wang, M. Wang, Y. Ling, W. Fan, and H. Yin, “Structural determination and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps sinensis,” The American Journal of Chinese Medicine, vol. 37, no. 5, pp. 977–989, 2009.
71. S. P. Li, G. H. Zhang, Q. Zeng et al., “Hypoglycemic activity of polysaccharide, with antioxidation, isolated from cultured Cordycepsmycelia,” Phytomedicine, vol. 13, no. 6, pp. 428–433, 2006.
72. Y. Wang, H. Yin, X. Lv, H. Gao, and M. Wang, “Protection of chronic renal failure by a polysaccharide from Cordyceps sinensis,” Fitoterapia, vol. 81, no. 5, pp. 397–402, 2010.
73. Y. Wang, D. Liu, H. Zhao et al., “Cordyceps sinensis polysaccharide CPS-2 protects human mesangial cells from PDGF-BB-induced proliferation through the PDGF/ERK and TGF-β1/Smad pathways,” Molecular and Cellular Endocrinology, vol. 382, no. 2, pp. 979–988, 2014.
74. Y. L. Wu, N. Hu, Y. J. Pan, L. Zhou, and X. Zhou, “Isolation and characterization of a mannoglucan from edible Cordyceps sinensis mycelium,” Carbohydrate Research, vol. 342, no. 6, pp. 870–875, 2007.
75. S.-H. Wang, W.-B. Yang, Y.-C. Liu et al., “A potent sphingomyelinase inhibitor from Cordyceps mycelia contributes its cytoprotective effect against oxidative stress in macrophages,” Journal of Lipid Research, vol. 52, no. 3, pp. 471–479, 2011.
76. W. Yalin, O. Ishurd, S. Cuirong, and P. Yuanjiang, “Structure analysis and antitumor activity of (1→3)-β-D-glucans (cordyglucans) from the mycelia of Cordyceps sinensis,” Planta Medica, vol. 71, no. 4, pp. 381–384, 2005.
77. J. K. H. Cheung, J. Li, A. W. H. Cheung et al., “Cordysinocan, a polysaccharide isolated from cultured Cordyceps, activates immune responses in cultured T-lymphocytes and macrophages: signaling cascade and induction of cytokines,” Journal of Ethnopharmacology, vol. 124, no. 1, pp. 61–68, 2009.
78. L. M. Seitz, “Ergosterol as a measure of fungal growth,” Phytopathology, vol. 69, no. 11, pp. 1202–1206, 1979.
79. W. F. Osswald, W. Holl, and E. F. Elstner, “Ergosterol as a biochemical indicator of fungal infection in spruce and fir needles from different sources,” Zeitschrift für Naturforschung, vol. 41, pp. 542–544, 1986.
80. Y. H. Li and X. L. Li, “Determination of ergosterol in Cordyceps sinensis and Cordycepsblack-bone chicken capsules by HPLC,” Acta Pharmaceutica Sinica, vol. 26, no. 10, pp. 768–771, 1991.
81. S. Kitchawalit, K. Kanokmedhakul, S. Kanokmedhakul, and K. Soytong, “A new benzyl ester and ergosterol derivatives from the fungus Gymnoascus reessii,” Natural Product Research, vol. 28, no. 14, pp. 1045–1051, 2014.
82. J. Zheng, Y. Wang, J. F. Wang, P. Liu, J. Li, and W. Zhu, “Antimicrobial ergosteroids and pyrrole derivatives from halotolerant Aspergillus flocculosus PT05-1 cultured in a hypersaline medium,” Extremophiles, vol. 17, no. 6, pp. 963–971, 2013.
83. S. B. Rajput and S. M. Karuppayil, “Small molecules inhibit growth, viability and ergosterol biosynthesis in Candida albicans,” SpringerPlus, vol. 2, article 26, no. 1, 2013.
84. L.-Y. Yang, W. J. Huang, H.-G. Hsieh, and C.-Y. Lin, “H1-A extracted from Cordyceps sinensis suppresses the proliferation of human mesangial cells and promotes apoptosis, probably by inhibiting the tyrosine phosphorylation of Bcl-2 and Bcl-XL,” Journal of Laboratory and Clinical Medicine, vol. 141, no. 1, pp. 74–83, 2003.
85. L.-Y. Yang, A. Chen, Y.-C. Kuo, and C.-Y. Lin, “Efficacy of a pure compound H1-A extracted from Cordyceps sinensis on autoimmune disease of MRL lpr/lpr mice,” Journal of Laboratory and Clinical Medicine, vol. 134, no. 5, pp. 492–500, 1999.
86. C.-Y. Lin, F.-M. Ku, Y.-C. Kuo et al., “Inhibition of activated human mesangial cell proliferation by the natural product of Cordyceps sinensis (H1-A): an implication for treatment of IgA mesangial nephropathy,” Journal of Laboratory and Clinical Medicine, vol. 133, no. 1, pp. 55–63, 1999.
87. J. W. Bok, L. Lermer, J. Chilton, H. G. Klingeman, and G. H. N. Towers, “Antitumor sterols from the mycelia of Cordyceps sinensis,” Phytochemistry, vol. 51, no. 7, pp. 891–898, 1999.
88. H. Matsuda, J. Akaki, S. Nakamura et al., “Apoptosis-inducing effects of sterols from the dried powder of cultured mycelium of Cordyceps sinensis,” Chemical and Pharmaceutical Bulletin, vol. 57, no. 4, pp. 411–414, 2009.
89. G. Bernardi, E. Appella, and R. Zito, “Studies on acid deoxyribonuclease. III. Physical and chemical properties of hog spleen acid deoxyribonuclease,” Biochemistry, vol. 4, no. 9, pp. 1725–1729, 1965.
90. M. Q. Ye, Z. Hu, Y. Fan, L. He, F. Xia, and G. Zou, “Purification and characterization of an acid deoxyribonuclease from the cultured mycelia of Cordyceps sinensis,” Journal of Biochemistry and Molecular Biology, vol. 37, no. 4, pp. 466–473, 2004.
91. H.-P. Li, Z. Hu, J.-L. Yuan et al., “A novel extracellular protease with fibrinolytic activity from the culture supernatant of Cordyceps sinensis: purification and characterization,” Phytotherapy Research, vol. 21, no. 12, pp. 1234–1241, 2007.
92. W.-F. Chiou, P.-C. Chang, C.-J. Chou, and C.-F. Chen, “Protein constituent contributes to the hypotensive and vasorelaxant activities of Cordyceps sinensis,” Life Sciences, vol. 66, no. 14, pp. 1369–1376, 2000.
93. P. Vestergaard, L. Rejnmark, and L. Mosekilde, “Diabetes and its complications and their relationship with risk of fractures in type 1 and 2 diabetes,” Calcified Tissue International, vol. 84, no. 1, pp. 45–55, 2009.
94. L. A. Ahmed, R. M. Joakimsen, G. K. Berntsen, V. Fønnebø, and H. Schirmer, “Diabetes mellitus and the risk of non-vertebral fractures: the Tromsø study,” Osteoporosis International, vol. 17, no. 4, pp. 495–500, 2006.
95. W. Qi, Y. Zhang, Y.-B. Yan et al., “The protective effect of cordymin, a peptide purified from the medicinal mushroom Cordyceps sinensis, on diabetic osteopenia in alloxan-induced diabetic rats,” Evidence-based Complementary and Alternative Medicine, vol. 2013, Article ID 985636, 6 pages, 2013.
96. J.-M. Jia, X.-C. Ma, C.-F. Wu, L.-J. Wu, and G.-S. Hu, “Cordycedipeptide A, a new cyclodipeptide from the culture liquid of Cordyceps sinensis (BERK.) SACC,” Chemical and Pharmaceutical Bulletin, vol. 53, no. 5, pp. 582–583, 2005.
97. J.-M. Jia, H.-H. Tao, and B.-M. Feng, “Cordyceamides A and B from the culture liquid of Cordyceps sinensis (Berk.) sacc,” Chemical and Pharmaceutical Bulletin, vol. 57, no. 1, pp. 99–101, 2009.
98. S. S. Zhang, D. S. Zhang, T. J. Zhu, and X. Y. Chen, “A pharmacological analysis of the amino acid components of Cordyceps sinensis SACC,” Acta Pharmaceutica Sinica, vol. 26, no. 5, pp. 326–330, 1991.
99. R. Chatterjee, K. S. Srinivasan, and P. C. Maiti, “Cordyceps sinesis (Berkeley) Saccardo: structure of cordycepic acid,” Journal of the American Pharmaceutical Association, vol. 46, no. 2, pp. 114–118, 1957.
100. J. Guo and S. L. Friedman, “Hepatic fibrogenesis,” Seminars in Liver Disease, vol. 27, no. 4, pp. 413–426, 2007.
101. Y. Y. Ouyang, Z. Zhang, Y. R. Cao, et al., “Effect of cordyceps acid and cordycepin on the inflammatory and fibrogenic response of hepatic stellate cells,” Chinese Journal of Hepatology, vol. 21, no. 4, pp. 275–278, 2013.
102. A. Z. Nomani, Z. Nabi, H. Rashid et al., “Osmotic nephrosis with mannitol: review article,” Renal Failure, vol. 36, no. 7, pp. 1169–1176, 2014.
103. M. A. Sahmeddini, S. Zahiri, M. B. Khosravi, S. Ghaffaripour, M. H. Eghbal, and S. Shokrizadeh, “Effect of mannitol on postreperfusion cardiac output and central venous oxygen saturation during orthotopic liver transplant: a double-blind randomized clinical trial,” Progress in Transplantation, vol. 24, no. 2, pp. 121–125, 2014.
104. Z.-Y. Zhu, Q. Yao, Y. Liu et al., “Highly efficient synthesis and antitumor activity of monosaccharide saponins mimicking components of Chinese folk medicine Cordyceps sinensis,” Journal of Asian Natural Products Research, vol. 14, no. 5, pp. 429–435, 2012.
[/toggle]




 2.3.1. Εργοστερόλη
2.3.1. Εργοστερόλη 2.3.2. H1-A
2.3.2. H1-A


































